Khí Sunfurơ là khí có nhiều ứng dụng trong công nghiệp và đời sống. Nhưng cũng là loại khí có rất nhiều tác hại. Thực tế cần phải sử dụng khí SO2 như thế nào? Khí Sunfurơ là gì? Các tính chất vật lý, tính chất hóa học, điều chế trong thực tế ra sao. Hãy cùng Công ty Xử Lý Chất Thải tìm hiểu thông qua các nội dung sau nhé.
Khí sunfurơ hay SO2 là gì?
Khí sunfurơ hay khí SO2 còn có tên gọi khác là lưu huỳnh điôxit (hay còn gọi là anhiđrit sunfurơ).
Khí sunfurơ được tạo ra khi đốt cháy lưu huỳnh.
Cụ thể hơn thì trong thực tế khí SO2 (axit sunfurơ) được sinh ra nhờ quá trình đốt cháy các nhiên liệu hóa thạch đặc biệt là than, dầu… hoặc phát sinh trong quá trình nấu chảy các quặng nhôm, đồng, kẽm, chì, sắt.
Muốn xem Tổng Hợp một số đồ Án – Giáo Trình Xử Lý Khí Thải- Xử lý Khí SO2 —> Hãy Truy Cập Vào link sau Để DOWNLOAD
https://xulychatthai.com.vn/tong-hop-bo-do-an-xu-ly-khi-thai-link-google-driver/
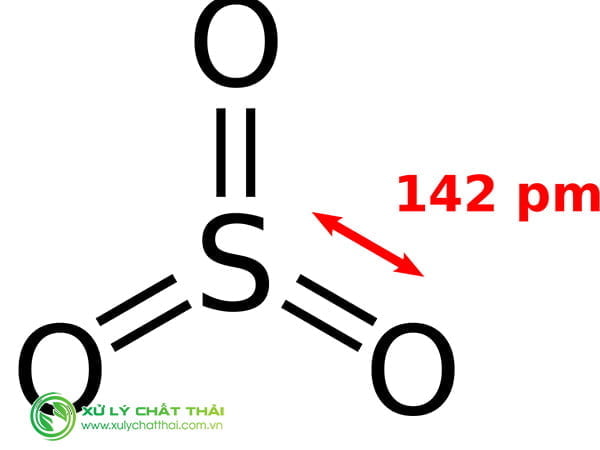
Cấu tạo phân tử và công thức cấu tạo khí Khí sunfurơ
Nguyên tử lưu huỳnh ở trạng thái kích thích có 4 electron độc thân ở các phân lớp 3p và 3d : … 3s2 3p3 3d1.
Những electron độc thân này của nguyên tử S sẽ liên kết với 4 electron độc thân của hai nguyên tử o tạo thành bốn liên kết cộng hoá trị có cực :
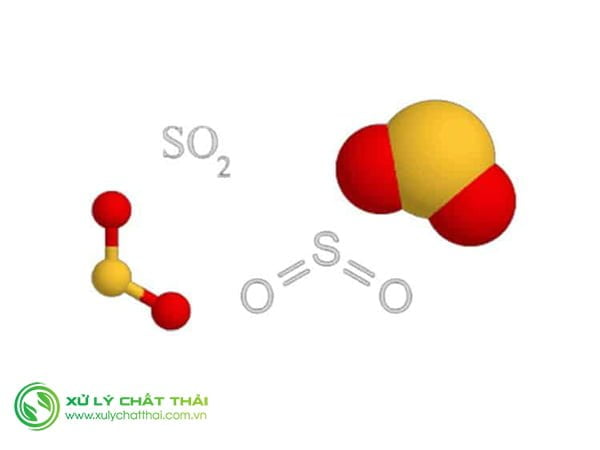
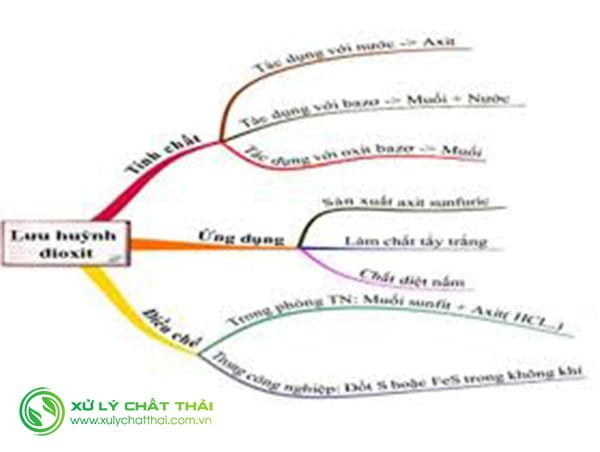
Tính chất vật lý Khí Sunfurơ
- Lưu huỳnh đioxit hay là Khí Sunfurơ chất khí không màu, mùi hắc, nặng hơn hai lần không khí, hoá lỏng ở -10°C.
- Lưu huỳnh đioxit tan nhiều trong nước (1 thể tích nước ở 20°C hoà tan được 40 thể tích khí so2).
- Lưu huỳnh đioxit là khí độc, hít thở phải không khí có SO2 sẽ gây viêm đường hô hấp.

Tính chất hóa học Khí Sunfurơ
Lưu huỳnh dioxit là oxit axit
- SO2 tan trong nước tạo thành dung dịch axit sunfuro (H2SO3)
Phương trình phản ứng
SO2 + H2O –> H2SO3
H2SO3 là axit yếu (mạnh hơn axit sunfuhidric) và không bền (ngay trong dung , dịch, H2SO3 cũng bị phân huỷ thành SO2 và H2O).
- SO2 tác dụng với dung dịch bazơ, tạo nên 2 loại muối : muối trung hoà, như Na2SO3, chứa ion sunfit ( SO3 ) và muối axit, như NaHSO3, chứa ion hidrosunfit ( HSO3 ).
Lưu huỳnh dioxit là chất oxy hóa trung gian.
Trong hợp chất SO2, nguyên tố lưu huỳnh có số oxi hoá +4, là số oxi hoá trung gian giữa các số oxi hoá -2 và +6. Do vậy, khi tham gia phản ứng oxi hoá – khử, so2 có thể bị khử hoặc bị oxi hoá.
- Lưu huỳnh đioxit thể hiện là chất khử khi tác dụng với những chất oxi hoá mạnh, như halogen, kali pemanganat.
Phương trình phản ứng
5SO2 + 2KMnO4 + 2H2O -> K2SO4+2MnSO4+2H2SO4
- Lưu huỳnh đioxit thể hiện là chất oxi hoá khi tác dụng với chất khử mạnh hơn, như H2S, Mg,…
Phương trình phản ứng
SO2+ 2H2S -> 3S + 2H2O
SO2 +2Mg -> s +2MgO
Tác hại Khí Sunfurơ
Khí Sunfurơ –một trong những nguyên nhân gây ô nhiễm không khí
Nguyên nhân chính (thực tê là nguyên nhân duy nhất) của sự hiện diện SO2 trong khí quyển. Đặc biệt là việc sử dụng nhiên liệu khoáng. Trước hết là than, vì nhiên liệu bất kỳ đều chứa ít nhiều lượng lưu huỳnh (từ một vài phần của phần trăm tối 5-7 %).
Theo các ước lượng, hàng năm thải vào lốp khí quyển đối lưu gần 145 triệu tấn SO2. Trong đó 70 % được tạo thành khi cháy than và 16 % – cháy nhiên liệu lỏng (đặc biệt là mazut).
Sự phân hủy SO2 trong khí quyển diễn ra dưối tác động của bức xạ cực tím. Và tạo thành anhyđrit hưu huỳnh (SO3) theo phản ứng
2SO2 +02 -+2S0, +185kJ.
Khi tiếp xúc vối hơi nước, sẽ tạo thành axit sunphua
so2 +H2O = H2SO3 + 76kJ.
Trong khí quyển ẩm và ô nhiễm còn xảy ra phản ứng
so2 +NO2 +H2O àH2SO4 +NO,
Dẫn đến tạo thành axit sunphuric (H2SO4).
Các ôxit lưu huỳnh làm tăng mạnh sự ăn mòn kim loại trong các thành phố. Cao hơn 1,5-5 lần so vối ở nông thôn. Tại một trong những thành phố của Mỹ, sự gia tăng nồng độ SO2 lên 3 lần kéo theo tăng tốc độ ăn mòn thiếc lên 4 lần. Đặc biệt vải nilon rất nhạy cảm đối vối sự ô nhiễm khí quyển bởi chất này.
Ảnh hưởng Khí Sunfurơ đối với sức khỏe con người
Điôxit lưu huỳnh (SO2) và sunphua anhyđrit (SO3) trong tổ hợp vối các hạt lơ lửng và hơi ẩm có tác hại nhất tối con người. Đặc biệt đối với cơ thể con người và các loại động vật
SO2 – chất khí không màu và không cháy. Với nồng độ trong không khí 0,3-1,0 phần triệu bắt đầu cảm thấy mùi của nó. Còn vối nồng độ cao hơn 3 phần triệu SO2 có mùi gắt khó chịu.
Điôxit lưu huỳnh trong hỗn hợp với những hạt rắn và axit sunphuric (một chất kích thích mạnh hơn SO2) ngay với hàm lượng trung bình năm 0,04-0,09 phần triệu và nồng độ khói 150-200 mg/m3 sẽ làm tăng các triệu chứng khó thở và các bệnh phổi. Còn vối hàm lượng SO2 trung bình ngày 0,2-0,5 phần triệu và nồng độ khói 500-700 mg/m3 quan sát thấy tăng mạnh số bệnh nhân và tử vong. Vối nồng độ SO2 0,3-0,5 phần triệu trong thời gian một số ngày sẽ xảy ra gây hại mãn tính đốĩ vối lá thực vật (đặc biệt là rau muống, xà lách, bông, bạch dương…).
Ứng dụng và điều chế lưu huỳnh đioxit
Ứng dụng
Lưu huỳnh đioxit được dùng để :
- Ứng dụng trong sản xuất axit sunfuric (H2SO4)
- Nguyên liệu tẩy trắng: giấy, bột giấy, dung dịch đường…
- Ứng dụng SO2 trong nông nghiệp. Dùng làm chất bảo quản cho các loại mứt quả sấy khô
- Là chất Kháng khuẩn và chống oxy hóa trong sản xuất rượu vang
Điều chế SO2 trong phòng thí nghiệm
Trong phòng thí nghiệm, SO2 được điều chế bằng cách đun nóng dung dịch axit H2SO4 với muối Na2SO3.
Thu SO2 vào bình bằng cách đẩy không khí.Na2SO3 + H2SO4 -> Na2SO4 + H2O + SO2
Điều chế SO2 trong Công nghiệp
- Đốt cháy lưu huỳnh.
Đốt quặng sunfua kim loại, như pirit sắt (FeS2) : 4FeS2 + 11O2 -> 2Fe2O3 + 8SO2
Tóm lại:
Trong bài viết trên, Công ty Xử Lý Chất Thải đã giới thiệu đầy đủ các kiến thức về khí SO2. Tuy nhiên do biên tập từ nhiều nguồn khác nhau, nên không tránh khỏi những thiếu sót. Hãy liên hệ với hotline: 0935.22.17.22 anh Hùng để được góp ý và giải đáp thắc mắc nhé.
Nguồn www.xulychatthai.com.vn