Điều chế Clo trong phòng thí nghiệm và trong công nghiệp như thế nào? Đó chính là toàn bộ thông tin mà chúng tôi muốn gửi đến với các bạn trong bài viết sau đây.
Như chúng ta đã biết, Clo cho dù tồn tại ở dạng lỏng hay khí đều có hại đối với sức khỏe con người. Về mặt sức khỏe thì đó là nguyên nhân gây nên các bệnh về đường hô hấp nhất là viêm họng và viêm mũi. Nhưng bên cạnh đó, Clo cũng là chất không thể thiếu khi ứng dụng trong khử trùng hoặc tẩy trắng.
Clo có lẽ là cái tên khá quen thuộc đối với tất cả chúng ta, Từ khi còn ngồi trong ghế nhà trường cho đến lúc bước ra cuộc sống thường ngày. Vậy bạn có nhớ những điều liên quan về chất hóa học CLO này không?
Tuy nhiên, trong tự nhiên Clo chủ yếu tồn tại ở dạng muối. Vậy quá trình điều chế Clo như thế nào? Cũng như tất tần tật kiến thức về tính chất của Clo sẽ được trình bày trong bài viết sau đây.
Muốn xem Tổng Hợp một số đồ Án – Giáo Trình Xử Lý Khí Thải—> Hãy Truy Cập Vào link sau Để DOWNLOAD
https://xulychatthai.com.vn/tong-hop-bo-do-an-xu-ly-khi-thai-link-google-driver/
Cl là gì?
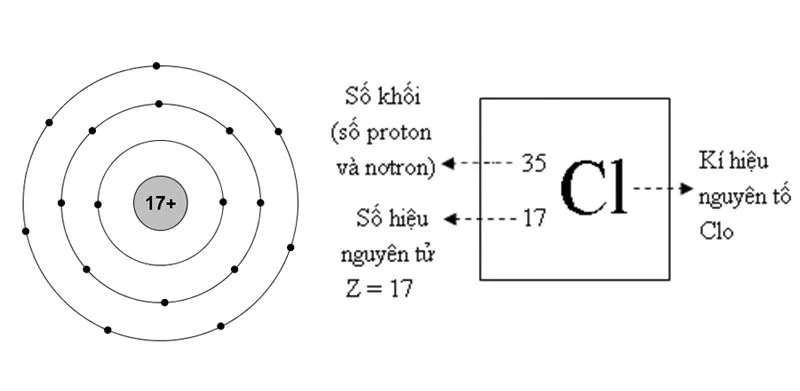
Clo hay Chlorine là một nguyên tố hóa học nằm trong bảng tuần hoàn nguyên tố. có ký hiệu Cl. Thuộc chu kì 3 của bảng tuần hoàn.
- Clo có ái lực điện tử cao nhất và có độ âm điện đứng thứ 3 trong tất cả các nguyên tố.
- Clo trong thực tế tồn tại ở 2 dạng đó là dạng lỏng và dạng khí.
- Nhóm, phân lớp17, p
- Số nguyên tửbằng 17.
- Phân loại là Halogen.
- Cấu hình electron [Ne] 3s2 3p5.
- Mỗi lớp chứa2 7 8 e
- Khối lượng nguyên tử chuẩn 453(2) g
- Cấu trúc tinh thể :
Tính chất vật lý của Clo
Clo là một nguyên tố phi kim thuộc nhóm halogen, tồn tại ở trạng thái khí trong điều kiện môi trường bình thường.
Khí Clo có màu vàng lục, mùi hắc và độc hại.
Khí Clo có thể tan trong nước và đặc biệt tan mạnh trong các dung môi hữu cơ.
Nặng hơn không khí khoảng 2.5 lần.
Trong môi trường tự nhiên, đa phần Clo được tìm thấy ở dạng muối clorua, phần lớn là muối ăn natri clorua, ngoài ra còn có kali clorua và một số khoáng vật như cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.
Tính chất hóa học của Clo
Nguyên tử clo có độ âm điện lớn (3,16), chỉ đứng sau nguyên tử flo (3,98) và nguyên tử oxi (3,44). Vì vậy, trong hợp chất với các nguyên tố này, clo có số oxi hoá dương (+1, +3, +5, +7), còn trong các trường hợp khác, clo có số oxi hoá âm (–1).
Khi tham gia phản ứng, nguyên tử clo dễ nhận thêm 1 e để thành ion clorua Cl–.
Vì vậy, tính chất hoá học cơ bản của clo là tính oxi hoá mạnh.
- Tác dụng với phi kim tạo ra muối halogenua (tạo ra muối có hóa trị cao nhất của kim loại đó) trừ bạch kim (Pt, Au). Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, tốc độ nhanh, toả nhiều nhiệt.
Phương trình phản ứng
2Fe + 3Cl2 → 2FeCl3
Mg + Cl2 → MgCl2
- Tác dụng với Hydro tạo thành Hydro clorua
Phương trình phản ứng
H2 + Cl2 → 2HCl
Điều kiện phản ứng xảy ra nếu tỷ lệ số mol của khí Clo với Hydro là 1:1
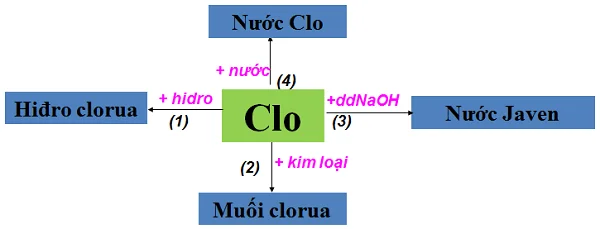
- Tác dụng với nước là phản ứng thuận nghịch
Phương trình phản ứng
H2O + Cl2 ↔ HCl + HClO (axit hipoclorơ)
Axit hipoclorơ có tính oxy hóa mạnh nên được dùng làm chất sát trùng, tẩy màu.
- Tác dụng với dung dịch muối những halogen yếu hơn clo, trong dãy hoạt động
Phương trình phản ứng
2NaBr + Cl2 → 2NaCl + Br2
- Tác dụng với chất khử mạnh
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
Do đó, Trong phòng thí nghiệm, amoniac được dùng làm chất khử độc Clo
Xem thêm: Dịch vụ hút hầm cầu tại Đà Nẵng có chất lượng thi công hàng đầu hiện nay.
Các cách điều chế khí Clo
Điều chế khí Clo trong phòng thí nghiệm (hcl ra cl2), (kcl ra cl2) (kmno4 ra cl2) (mno2 + hcl đặc)
Phương pháp điều chế Clo trong phòng thí nghiệm
Đun nóng nhẹ dung dịch axit HCl đậm đặc với chất có khả năng oxy hóa mạnh như mangan dioxit (MnO2).
Phương trình phản ứng xảy ra như sau:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Nếu muốn thu được khí Clo tinh khiết, cần tiếp tục thực hiện các bước sau:
- Cho khí Clo qua bình axit sulfuric đặc, nó sẽ được làm khô nước.
- Thu khí Clo bằng phương pháp đẩy không khí do khí Clo nặng hơn không khí.
- Sử dụng bông tẩm xút, tránh khí Clo bay ra bên ngoài vì Clo là khí độc
Ngoài MNO2 có thể dùng một số chất oxy hóa khác như kali pemanganat (KMnO4), Kali Clorat (KClO3), Clorua vôi (CaOCl2).c
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Điều chế Clo trong phòng thí nghiệm bằng Kali pemanganat
KClO3 + 6HCl → KCl + 3H2O + 3Cl2
CaOCl2 + 2HCl → Cl2 + CaCl2 + H2O
Điều chế khí Clo trong công nghiệp (nacl ra cl2)
Điều chế Clo trong phòng thí nghiệm chỉ thu được một lượng nhỏ, không đủ phục vụ cho nhiều ứng dụng trong cuộc sống.
Do đó, điều chế công nghiệp là việc rất cần thiết. Các nhà sản xuất tiến hành điện phân muối Natri Clorua bằng điện phân nóng chảy theo phương trình phản ứng:
2NaCl → 2Na + Cl2
Hoặc điện phân có màng ngăn dung dịch muối halogenua (natri clorua)
2NaCl + 2H2O → H2 + 2NaOH + Cl2
Ứng dụng của khí Clo trong thực tế
- Axit hypocloro HClO được dùng để khử trùng nước uống và nước hồ bơi.
- Clo được dùng khá phổ biến trong sản xuất giấy, khử trùng, thuốc nhuộm sợi vải, thực phẩm, thuốc diệt trừ sâu bệnh hại, các loại sơn, công nghiệp hóa dầu, sản xuất chất dẻo dung môi và rất nhiều sản phẩm tiêu dùng khác.
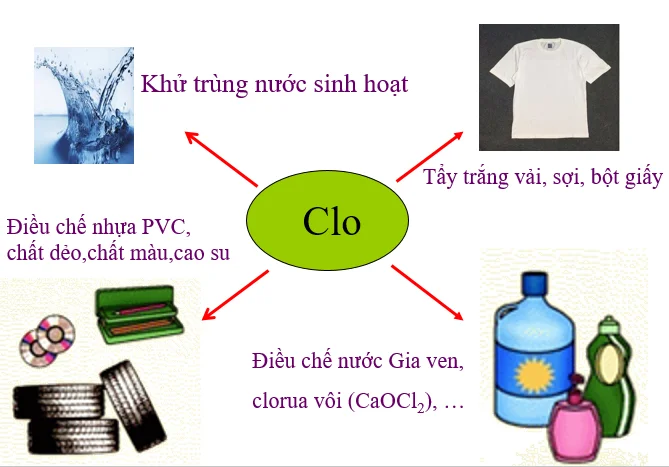
- Khí Clo được dùng để làm sạch nước, tẩy trắng hoặc khử trùng
- Là thuốc thử của ngành công nghiệp hóa chất
- Sản xuất nước Ja-ven, Clorua vôi, axit clorua….
- Người ta cũng dùng Clo để sản xuất Clorat, Clorofom, tetraclorua cacbon cũng như chiết xuất brom.
- Điều chế nhiều loại dung môi công nghiệp như cacbon tetra clorua để sản xuất nhiều chất polime như nhựa PVC, cao su tổng hợp…
- Điều chế Clo trong phòng thí nghiệm để dùng cho các phản ứng hóa học, phục vụ công tác giảng dạy, nghiên cứu.
Mức độ nguy hiểm của khí Clo
- Trộn khí Clo với nước tiểu hoặc sản phẩm tẩy rửa sẽ sản sinh khí độc gồm Clo và triclorua nito. Do đó cần thận trọng với hỗn hợp này.
- Trong trường hợp phơi nhiễm khí Clo nồng độ cao, dù không gây nguy hiểm tới tính mạng con người nhưng cũng làm tổn thương nghiêm trọng trong phổi như tích tụ huyết thanh hoặc phồng rộp.
- Phơi nhiễm Clo thấp làm phổi suy yếu, dễ bị rối loạn hô hấp
- Đối với trẻ nhỏ và người cao tuổi, khí Clo dễ gây kích ứng màng nhày, cháy da.
Nguồn Tổng hợp / https://xulychatthai.com.vn/